【骨鬆Q&A 034】ACLASTA® AE(AF、RENAL FUNCTION)
【骨鬆Q&A 034】Aclasta® AE(Af、Renal Function)
Aclasta® AE重要副作用有【注射後症狀】、【腎功能影響】、【下頜骨壞死】、【非典型骨折】及【心房顫動】等。
這裡討論【腎功能影響】與【心房顫動】。
【腎功能】
FDA用藥安全報導2009年第二期第二卷
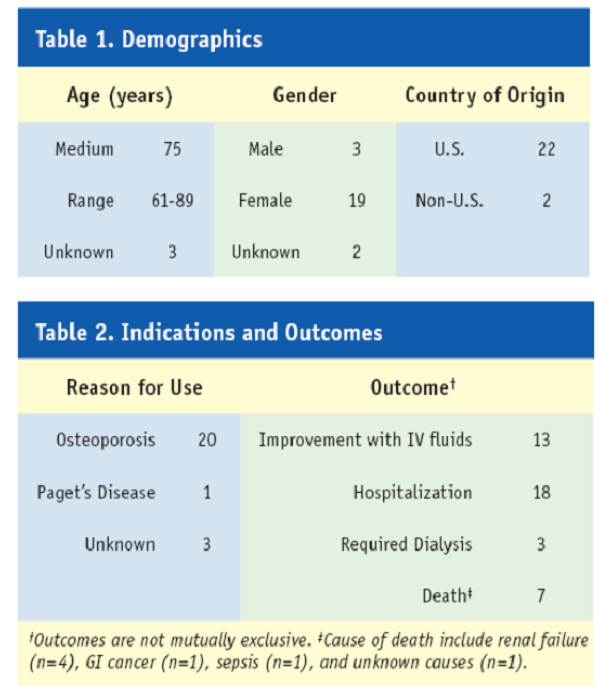
根據2009年1至3月的不良反應通報系統,列出可能有潛在風險的藥物。包括Aclasta®,文中特別著明這些藥物有『潛在風險』,不表示FDA認為該藥物與不良反應具有『因果相關』。這樣的報導,可以讓醫師及時知道藥品的安全性及注意並預防不良反應的發生。FDA會針對這些藥物作進一步的分析與評估再進一步公告出來。
在上市一段時間後,依據不良反應通報,FDA就Aclasta®的腎功能安全做了一份報導,這是一份定期報導,與藥品安全警告不同。
由於當時Aclasta® 上市時間不長,許多醫師對於正確使用Aclsata仍不熟悉,在有嚴謹設計的臨床試驗中,僅有1.81%患者有短暫、可回覆性的Ccr上升,約在用藥後9-11天發生,而後自行緩解。
長期觀察安慰劑組與Aclasta®組的腎功能變化並無差異。由於Aclasta 經腎臟原型排除,參考藥品仿單使用使用Aclasta®進行單次30分鐘輸液(約一秒一滴)提供全年的治療效益。
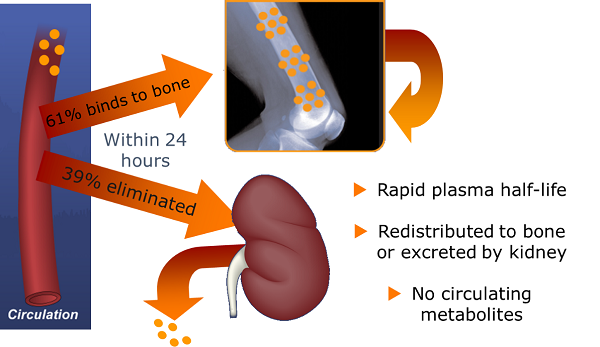
ZOL藥物動力學(Chen T 2002)
- 雙磷酸鹽具有快速的血漿半衰期,並重新分配到骨骼或由腎臟排泄,沒有循環代謝物。
- 靜脈輸注ZOL導致劑量依賴性峰值血漿濃度,隨後快速,多相降低至24小時內峰值濃度的1%以下。
- 在最初的24小時內,大約40%的給藥劑量在尿液中排泄,並且與4至16mg之間的劑量無關。
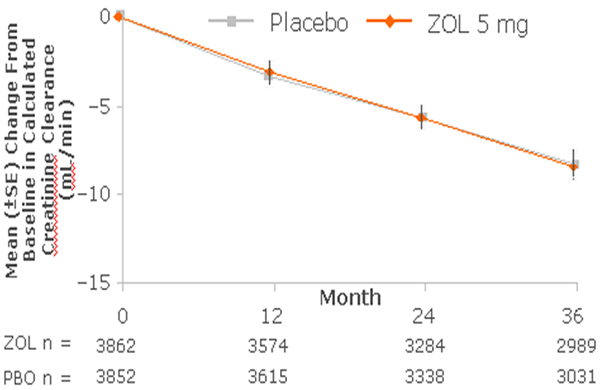
在HORIZON PFT (STUDY 2301)中, 長時間(三年)追蹤Aclasta®與安慰劑組腎功能變化, 兩組Ccr 變化相當, Aclasta® 對腎功能並無蓄積性的負面影響 (Black DM 2007)。
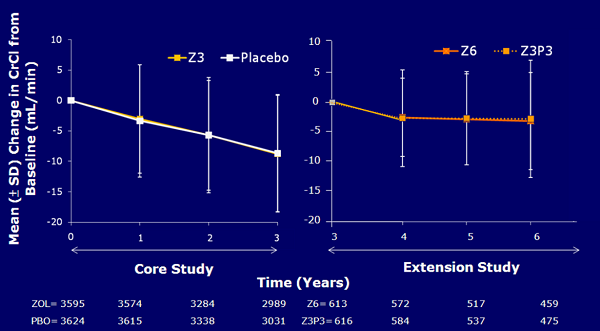
由Aclasta® 6 年研究發現,Aclasta®一年一針對於腎功能並無蓄積性的影響 (Black DM 2010 )。
在正確使用Aclasta®情況下, 沒有證據作證使用Aclasta®導致腎功能惡化
在臨床試驗中1.81% Of Patients (vs 0.81% Placebo)通報有短暫的血肌酸酐上升。
上市後安全通報紀錄蒐集到有1.8/10,000的患者通報腎功能降低,多數患者有其他併用藥物或相關病史
臨床上須考量雙磷酸鹽類確有造成腎功能惡化之風險。

- 確認患者Ccr ≥35 ml/min。
- 滴注時間大於30分鐘。
- 確定患者於注射前攝取/接受足夠的水分補充。
- 在嚴重腎功能不全患者,不應使用任何雙磷酸鹽類藥物。
【AF】
使用 Aclasta®得到AF的風險並未比安慰劑高
於study 2301中兩組AF通報率並無差異
在study 2301中1.3% with Aclasta® vs 0.6% with placebo
在study 2310中1.1% with Aclasta® vs 1.3% with placebo
並無機轉可解釋AF發生率增加。
多數案例通報時,血液循環中早無Aclasta®藥物濃度殘留。
小魏醫師總結,從開始使用Aclasta®,皆合併生理食鹽水250ml同時輸注,注射時間拉到30分鐘以上,再加上給予預防性的NSAIDs三天(Panadol)基本上遠離注射後不適。其他重大AE,如【腎功能影響】、【下頜骨壞死】、【非典型骨折】及【心房震顫】其實都屬罕見,只要抓對診斷、適應症,並且定時回診追蹤,這些AE不足以影響疾病的治療。
【參考資料】
- Black DM (2010 ). "The effect of 3 versus 6 years of zoledronic acid treatment in osteoporosis: a randomized extension to the HORIZON-Pivotal Fracture Trial (PFT)." ASBMR
- Black DM, D. P., Eastell R, (2007). "for the HORIZON Pivotal Fracture Trial. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis." N Engl J Med 356: 1809-1822.
- Chen T, B. J., Vescio, (2002). "Pharmacokinetics and pharmacodynamcis of zoledronic acid in cancer patients with bone metastases." J Clin Pharmacol. 42: 1228-1236.